![]()
Vamos a revisar los conceptos teóricos básicos para saber el tipo de geometría de una molécula ABn (A = átomo central).
- Llamaremos número de direcciones del átomo central a la suma del número de átomos a los que se une (n) y el número de pares solitarios que tiene (orbitales de valencia que están llenos y que no comparte).
- El método de Repulsión de Pares de Electrones del Nivel de Valencia (RPENV) afirma que las direcciones que rodean al átomo central se orientarán de forma que adquieran una disposición en la que estén lo más alejadas posibles unas de las otras, para que las repulsiones entre ellas sean mínimas (recordemos que las direcciones son al fin y al cabo electrones y estos tienen carga negativa).
En concreto:
|
Nº de direcciones |
Ángulo |
Geometría de las Direcciones |
|
2 |
180º |
Lineal |
|
3 |
120º |
Triangular |
|
4 |
109,5º |
Tetraédrica |
|
5 |
90º, 120º y 180º |
Bipirámide Trigonal |
|
6 |
90º y 180º |
Octaédrica |
Nota: No hay que confundir la geometría de las direcciones con la geometría de la molécula, que es la que los núcleos forman (sin tener en cuenta los pares solitarios).
- El hecho de que en las moléculas haya ángulos algo menores que los valores que aparecen en el punto anterior, se debe a que la repulsión entre los electrones que forman parte de los pares solitarios es mayor que la repulsión entre los electrones de un par solitario y otro enlazante, y ésta aún mayor que la repulsión entre los electrones de dos pares enlazantes. Esto provoca que los ángulos entre los pares solitarios se abran y en consecuencia se cierren los ángulos entre los pares enlazantes.
- La teoría de la hibridación ha tratado de justificar cómo pueden formar los átomos mediante el solapamiento de orbitales atómicos (T.E.V.) los ángulos anteriormente indicados.
Para ello, los orbitales s, p (e incluso d) deben de hibridarse en el átomo central, para que en su lugar dicho átomo presente orbitales atómicos hibridados denominados sp, sp2, sp3, sp3d o sp3d2 que formen entre ellos los ángulos citados en un punto anterior. Dichos híbridos podrán así solaparse con orbitales atómicos de otros átomos formando los enlaces covalentes en esas direcciones.
Los orbitales híbridos tienen un lóbulo grande y otro pequeño, como aparece en el dibujo.
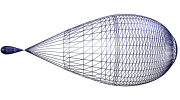
Orbitales sp: 2 orbitales que proceden de la combinación de un orbital s y un orbital p. Forman entre ellos 180º.

Orbitales sp2 : 3 orbitales que proceden de la combinación de un orbital s y dos orbitales p. Forman entre ellos 120º.

Orbitales sp3 : 4 orbitales que proceden de la combinación de un orbital s y tres orbitales p. Forman entre ellos 109,5º.

Orbitales sp3d : 5 orbitales que proceden de la combinación de un orbital s, tres orbitales p y un orbital d. Los ángulos entre ellos son: 120º, 90º y 180º.

Orbitales sp3d2 : 6 orbitales que proceden de la combinación de un orbital s, tres orbitales p y dos orbitales d. Los ángulos que forman entre ellos sonForman entre ellos son: 90º y 180º.

- Para ver si la molécula tiene separación de cargas y estudiar su polaridad hay que ver no sólo si sus enlaces covalentes son o no polares, sino también la geometría de la molécula.
Dependiendo de ésta, los vectores momento dipolar pueden anularse o no
|
|
|
|
|
Sentido: del núcleo del átomo al par solitario del mismo |
Si todas las direcciones del átomo central son iguales:
|
|
|
MOLÉCULA
APOLAR |