
El enlace covalente es la unión que como resultado de la compartición de uno o más pares de electrones se establece entre dos átomos. De esta forma, distinguimos entre enlace simple o sencillo (los átomos comparten un solo par de electrones), enlace doble (los átomos comparten dos pares de electrones) o enlace triple (los átomos comparten tres pares de electrones).
Según la T.E.V. (Teoría del Enlace de valencia) la compartición de electrones en un enlace covalente se produce por el solapamiento de dos orbitales de dos átomos que están semiocupados (en cuyo caso el spin del electrón de cada orbital ha de ser antiparalelo) o de un orbital lleno y otro vacío. El enlace formado en este último caso recibe el nombre de enlace covalente coordinado o dativo. En cualquier caso, el solapamiento puede ser:
- Frontal: si los dos orbitales atómicos se superponen enfrentados por sus extremos. El enlace que se forma en este caso se denomina σ y la densidad electrónica es máxima entre los núcleos.

- Lateral: si los dos orbitales atómicos se superponen paralelamente, de forma que la densidad electrónica sea máxima por encima y por debajo de la línea internuclear. Este enlace se denomina π, y es más débil (su energía de enlace es menor) que el σ.

Un enlace sencillo es siempre σ, mientras que en un enlace múltiple sólo uno de los enlaces es σ y el resto son enlaces π.
Un compuesto donde sólo hay enlaces covalentes (y no intermoleculares) está formado únicamente por átomos y se denomina ATÓMICO o COVALENTE. Las fórmulas de estos compuestos son empíricas: representan la proporción de átomos en la red. Por ejemplo la fórmula SiO2 representa que hay doble número de átomos de oxígeno que de átomos de silicio. No tiene sentido decir que en el dióxido de silicio hay dos átomos de oxígeno y uno de silicio, ya que estos 3 átomos no forman ninguna entidad independiente como molécula. En general, se utiliza la nomenclatura estequiométrica de la IUPAC para nombrarlos.
Conceptos importantes:
- Covalencia: nº de electrones que un átomo comparte y que (a excepción de si los enlaces son dativos) coincide con el número de electrones que tiene desapareados.
- Energía de enlace A-B: energía necesaria para romper un mol de enlaces A-B o la que se desprende al formarse el mismo número de enlaces A-B. Se acostumbra a dar en kJ/mol.
- Longitud de enlace: distancia (generalmente en picómetros) entre los núcleos de los dos átomos que están formando el enlace.
- Polaridad de un enlace covalente: Para entender este concepto debemos comenzar por recordar que la electronegatividad es la medida de la atracción que ejerce un átomo sobre los electrones que comparte con otros. Dependiendo de la electronegatividad de los átomos, los enlaces covalentes pueden ser:
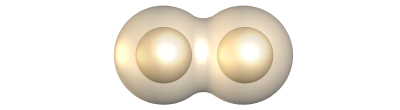
Apolares:
Si los dos átomos tienen la misma electronegatividad y por tanto la distribución de carga electrónica entre los núcleos es totalmente simétrica.
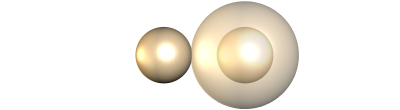
Polares:
Si los dos átomos tienen distinta electronegatividad. En este caso, uno de ellos atrae más los electrones del enlace que el otro, estableciéndose una separación de cargas (que simbolizaremos como δ+ y δ-) o lo que es igual, la distribución de carga electrónica entre los núcleos será asimétrica.

NOTA
El enlace iónico sería una extrapolación del enlace covalente polar en el que la diferencia de electronegatividad es tan grande que uno de los dos átomos se ha quedado con los electrones que el otro le ha cedido.
Para
medir la polaridad de un enlace covalente disponemos de la magnitud vectorial
denominada momento dipolar, que se representa por el vector ![]() :
:![]()
de módulo: ![]()
0 ≤ δ ≤ 1
e = carga del electrón
d = distancia de enlace o longitud de enlace
Unidad = Debye = 3,3·10-30 C·m (Culombio·metro)
dirección: El de la recta que une los átomos (núcleos) que forman el enlace.
sentido: de δ+ a δ- (del átomo menos electronegativo al más electronegativo)